Vímos por las redes ¡el descubrimiento del siglo! Se trata de cocinas que usan agua de lluvia para que mediante electrólisis, generar higrógeno (gas altamente explosivo y difícil de manejar) “desmitificamos con datos” leé lo que sigue:
A – ¿Que desechos se producen el generar hidrógeno a partir del agua?
La producción de hidrógeno a partir del agua, conocida como electrólisis del agua, descompone el agua (H₂O) en hidrógeno (H₂) y oxígeno (O₂) mediante una corriente eléctrica. Este proceso, cuando es completamente eficiente, no genera residuos tóxicos ni productos de desecho, solo hidrógeno y oxígeno gaseosos. Los subproductos son, por lo tanto, inofensivos:
- Hidrógeno: el producto principal, que puede usarse como combustible limpio.
- Oxígeno: es un subproducto que puede ser liberado a la atmósfera o capturado para otros usos industriales.
Sin embargo, la electricidad utilizada para la electrólisis es un factor relevante para evaluar su sostenibilidad. Si la energía proviene de fuentes renovables, la producción de hidrógeno puede considerarse un proceso limpio. En cambio, si se usa energía proveniente de combustibles fósiles, el impacto ambiental global del proceso se incrementa debido a las emisiones de CO₂ asociadas a la generación de esa electricidad.
¿el agua con sal remanente que se utilizó y que queda en la cuba electrolítica en que se transforma?
En la electrólisis de agua con sal, comúnmente se emplea cloruro de sodio (NaCl) como electrolito para mejorar la conductividad de la solución. Durante el proceso, ocurren algunas reacciones adicionales en la cuba electrolítica que generan productos secundarios, dependiendo de las condiciones específicas. Los productos principales que se generan suelen ser:
- Gas cloro (Cl₂): En el ánodo (polo positivo), se produce cloro gaseoso debido a la oxidación de los iones de cloruro (Cl⁻). Este gas es tóxico y debe ser manejado adecuadamente si se genera en grandes cantidades.
- Gas hidrógeno (H₂): En el cátodo (polo negativo), se produce hidrógeno gaseoso a partir de los iones de hidrógeno (H⁺) del agua. Este es el producto deseado en la mayoría de los casos.
- Hidróxido de sodio (NaOH): En solución, el sodio (Na⁺) se combina con los iones de hidróxido (OH⁻) que se forman al descomponer el agua. Esto produce una solución de hidróxido de sodio, que es altamente alcalina.
Por lo tanto, la solución remanente en la cuba electrolítica contiene hidróxido de sodio, que es una sustancia corrosiva y debe manejarse con cuidado. Además, si no se recolecta el cloro gaseoso producido en el ánodo, puede disolverse parcialmente en el agua, formando una solución de ácido hipocloroso (HClO) o cloruro de sodio (NaCl) residual, dependiendo del pH y la concentración.
B – ¿el hidróxido de sodio puede afectar la salud del ser humano?
Sí, el hidróxido de sodio (NaOH), también conocido como soda cáustica, puede afectar la salud humana y debe ser manejado con precaución debido a su naturaleza corrosiva. Sus efectos en la salud dependen de la concentración y la forma de exposición:
- Contacto con la piel: El hidróxido de sodio puede causar quemaduras graves y dolorosas en la piel, e incluso destruir tejidos en exposiciones de alta concentración. Las quemaduras químicas pueden tardar en sanar y, en algunos casos, dejan cicatrices.
- Contacto con los ojos: La exposición directa a los ojos puede ser extremadamente peligrosa y causar daño ocular severo, incluyendo quemaduras en la córnea y posible pérdida de visión.
- Inhalación: Inhalar polvo o aerosol de hidróxido de sodio puede irritar el tracto respiratorio, causando tos, dificultad para respirar y, en casos graves, daño pulmonar.
- Ingestión: La ingestión accidental de hidróxido de sodio es peligrosa, ya que puede causar quemaduras en la boca, garganta, esófago y estómago, provocando dolor intenso y complicaciones graves.
Por estas razones, el hidróxido de sodio debe ser manipulado usando equipo de protección adecuado, como guantes, gafas de seguridad y mascarillas, especialmente en su forma concentrada.
C – ¿cuanto hidrógeno en metros cúbicos haría falta utilizar para mantener funcionando una hornalla de cocina para cocinar durante una hora?
Calculemos cuánta cantidad de hidrógeno sería necesaria para mantener una hornalla de cocina funcionando durante una hora. La energía generada depende del poder calorífico del hidrógeno, que indica cuánta energía puede liberar una cierta cantidad de este gas al quemarse.
Datos necesarios:
- Poder calorífico del hidrógeno: aproximadamente 12.7 MJ/m3 (megajulios por metro cúbico) cuando se quema en condiciones estándar.
- Consumo típico de una hornalla: una hornalla de cocina puede consumir alrededor de 2.5 kW (kilovatios) para una llama media a alta.
Cálculos:
- Convertir el consumo de energía de la hornalla a joules:
Energía necesaria=Potencia×Tiempo
La potencia es 2.5 kW=2500 W, y el tiempo es 1 hora=3600 s
Energía necesaria=2500 W×3600s = 9.000.000 J = 9 MJ
- Calcular el volumen de hidrógeno requerido: Sabemos que el hidrógeno tiene un poder calorífico de 12.7 MJ/m3, lo cual significa que cada metro cúbico de hidrógeno puede liberar 12.7 MJ.

Se necesitarían aproximadamente 0.71 metros cúbicos de hidrógeno para mantener una hornalla de cocina encendida durante una hora.
D – ¿Cuanta energía en Kw y cuantos litros de agua hacen falta para generar por electrolisis 0,73m3 de hidrógeno y cuanto duraría este proceso?
Para producir hidrógeno mediante electrólisis, necesitamos dividir agua en hidrógeno y oxígeno aplicando una corriente eléctrica. Calcularemos la energía requerida, la cantidad de agua necesaria y el tiempo estimado para generar 0.73 m3 de hidrógeno.
Paso 1: Energía necesaria para la electrólisis
- Cantidad de hidrógeno:
Necesitamos producir 0.73 m3 de hidrógeno.
- Poder calorífico del hidrógeno:
Sabemos que 0.73 m3 de hidrógeno contiene una energía de:
Energía = 0.73 m3 × 12.7 MJ/m3 ≈ 9.27 MJ
- Eficiencia de la electrólisis:
Los sistemas de electrólisis suelen tener una eficiencia del 70-80%. Usaremos una eficiencia del 75% para el cálculo.
La energía eléctrica requerida para producir esta cantidad de hidrógeno será:

Paso 2: Cantidad de agua necesaria
- Ecuación de reacción del agua en electrólisis: La electrólisis del agua sigue la reacción:
2 H2O → 2 H2 + O2
Esto significa que 2 moles de agua producen 2 moles de hidrógeno.
- Volumen molar y masa de agua:
- 1 mol de gas ocupa aproximadamente 22.4 L a condiciones estándar.
- La masa molar de H2O es 18 g/mol.
Para obtener 0.73 m3=730 L hidrógeno:
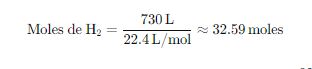
Como cada 2 moles de agua producen 2 moles de hidrógeno, necesitamos 32.59 moles de agua, lo cual corresponde a una masa de:
Masa de agua = 32.59 moles ×18 g/mol ≈ 586.62 g = 0.586 kg = 0.586 litros
Paso 3: Tiempo de electrólisis
- Corriente de trabajo: Supongamos una celda de electrólisis que trabaja a 2V y consume 20A (lo cual es común en celdas pequeñas).
- Potencia: La potencia de la celda sería:
Potencia = 2V × 20A = 40W = 0.04kW
- Tiempo de operación: Dado que necesitamos 3.43 kWh

E – Finalmente y en síntesis
- Energía requerida: para mantener una hornalla encendida durante una hora aproximadamente 3.43 kWh.
- Agua necesaria: aproximadamente 0.586 litros.
- Tiempo de electrólisis: para generar el hidrógeno necesario para cocinar durante 1 hora es de aproximadamente 85.75 horas con una celda de 40 W.
- Para reducir el tiempo de electrólisis para que 1 hora de uso = a 1 hora de generación: se necesita 1 celda de 3.43kWh. o 3.430W.
- Teniendo disponibles 12 Volts de baterías: esto representa un consumo de 3430W /12 Vdc = 285Amperes. (implica poner en paralelo 3 (tres) baterías de 12Vdc y 120A cada una.

Wonderful!
Thank You! Marcelo.